I seguenti regolamenti e linee guida sono fonti di informazione di base per i requisiti della pista di controllo:
- MHRA, Integrità dei dati1
- GMP UE, Allegato 11: Sistemi computerizzati2
- FDA, CFR 21 Parte113
- ISPE, GAMP Integrità dei dati4
- ISPE, GAMP55
- PIC/s, Integrità dei dati in ambienti GMP/GDP regolamentati6
Il metodo.
La ricerca e la relativa selezione di regolamenti e linee guida può portare a un'ampia raccolta di testi. Questi testi devono essere analizzati e messi in forma compatta. Un metodo utile a questo scopo è l'analisi qualitativa dei contenuti, secondo Mayring.7
Mayring descrive innanzitutto l'analisi del contenuto e l'analisi qualitativa, per poi ricavare i quattro principi per lo sviluppo di un'analisi qualitativa del contenuto. In sintesi, i principi sono i seguenti: Un'analisi qualitativa dei contenuti
- deve essere caratterizzato da un approccio sistematico.
- deve inserire il materiale in un modello di comunicazione.
- utilizza un sistema di categorie come centro di analisi.
- deve poter essere misurato in base a criteri di qualità scientifica.
Oltre al modello generale di processo analitico del contenuto, Mayring descrive anche tecniche qualitative speciali che risultano in sette forme di analisi per l'analisi testuale orientata qualitativamente, che sono divise in tre gruppi:
Forme di base | Sottogruppi |
|---|---|
Riassunto | Riassunto Formazione induttiva delle categorie |
Spiegazione | analisi del contesto ristretto ampia analisi del contesto |
Spiegazione | Strutturazione formale strutturazione del contenuto strutturazione tipica strutturazione in scala |
Tabella 1: Forme di analisi dell'analisi qualitativa del contenuto secondo Mayring
Le forme di analisi elencate nella tabella 1 descrivono i principi di base con i loro sottogruppi. Il riassunto mira a ridurre il materiale iniziale senza cambiare il messaggio centrale. La spiegazione implica l'espansione del materiale per renderlo più comprensibile. La strutturazione consiste nel filtrare il materiale essenziale e nel riorganizzarlo.
Sulla base delle forme di analisi dell'analisi qualitativa del contenuto, Mayring deriva una procedura per riassumere l'analisi del contenuto, che è la seguente:
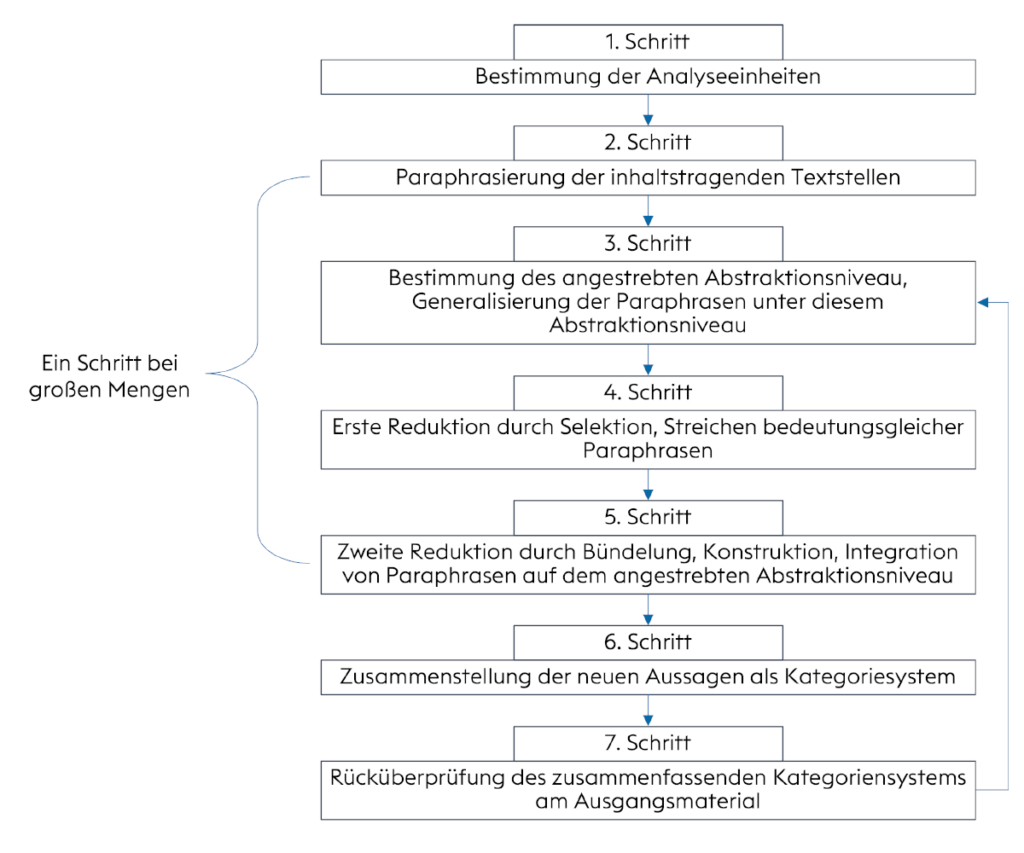
Dal momento che Mayring applica la metodologia degli esempi alla valutazione delle interviste, per il caso specifico della formulazione di requisiti per la pista di controllo, una sintesi dell'analisi descritta da Mayring avviene con i seguenti passi:
- Materiale del set
- Analizzare il materiale
- Ridurre il materiale
- Controllare il materiale ridotto per la dichiarazione iniziale
La Figura 2 mostra il modello di analisi del materiale disponibile in forma di testo e la riduzione del contenuto associato alla versione finale.

Dopo aver esaminato il materiale, si decide quale contenuto è rilevante (ad esempio per la pista di controllo). Il risultato intermedio è una raccolta di materiali, simboleggiata nella Figura 2 dal simbolo del documento dopo la fase del processo "Determinare il materiale".
Segue un'ulteriore analisi del materiale raccolto. In una prima fase, i contenuti rilevanti (paragrafi, passaggi, frasi) vengono ridotti in modo tale che rimangano solo le affermazioni essenziali. In una seconda fase di riduzione, la dichiarazione centrale viene riprodotta con parole proprie.
Per assicurarsi che l'affermazione non sia falsata dalle proprie parole, è necessario controllare il materiale di partenza. Se non ci sono scostamenti, la dichiarazione è considerata definitiva. Nel processo mostrato, questo è rappresentato dal secondo simbolo del documento.
Applicazione pratica.
Fase 1: Determinazione del materiale.
A causa dei requisiti normativi e delle linee guida sopra menzionate, inizialmente verrà preso in considerazione solo l'Allegato 11 delle linee guida GMP dell'UE.
Fase 2: analizzare il materiale.
Il seguente estratto sulla pista di controllo si trova nel materiale specificato:
Tracce di audit
Sulla base di una valutazione del rischio, si dovrebbe prendere in considerazione la possibilità di inserire nel sistema la creazione di una registrazione di tutte le modifiche e le cancellazioni rilevanti per le GMP (una "traccia di audit" generata dal sistema). Per la modifica o la cancellazione di dati rilevanti per le GMP, il motivo deve essere documentato. Le tracce di controllo devono essere disponibili e convertibili in una forma generalmente comprensibile e riviste regolarmente.
8
Tracce di audit
Sulla base di una valutazione del rischio, si dovrebbe prendere in considerazione la possibilità di integrare nel sistema la registrazione di tutte le modifiche e le cancellazioni rilevanti per le GMP (una traccia di audit generata dal sistema). Quando i dati rilevanti per le GMP vengono modificati o cancellati, il motivo deve essere documentato. Le tracce di audit devono essere disponibili, devono poter essere convertite in una forma generalmente leggibile e devono essere riviste regolarmente.
Fase 3: ridurre il materiale.
La riduzione del materiale può essere effettuata mediante punti elenco:
I requisiti per una traccia di audit generata dal sistema sono
- Registrazione di tutte le modifiche rilevanti per le GMP
- Registrazione di tutte le cancellazioni rilevanti per le GMP
- Registrare le ragioni delle modifiche rilevanti ai fini delle GMP.
- Registrazione dei motivi delle cancellazioni rilevanti per le GMP
- Disponibilità della pista di controllo
- La conversione in forma generalmente leggibile deve essere possibile
- È necessario eseguire ispezioni regolari
Fase 4: controllare il materiale ridotto per la dichiarazione iniziale.
In questo caso non solo si verifica se la riduzione del materiale ha modificato le affermazioni iniziali, ma anche se è necessaria un'esplicazione. Questo potrebbe avvenire, ad esempio, se le affermazioni sono poco chiare e ambigue e quindi hanno senso delle spiegazioni supplementari.
Le prime due affermazioni devono essere integrate nei requisiti con esempi concreti. È necessario definire quali sono le modifiche rilevanti per le GMP e quali no. Idealmente, la traccia di controllo dovrebbe registrare tutte le modifiche. Una suddivisione di ciò che è rilevante per le GMP e ciò che non lo è può essere fatta in una SOP per la revisione della pista di controllo. Qui si stabilisce quali contenuti della pista di controllo devono essere rivisti regolarmente.
Per quanto riguarda i punti 3 e 4, è necessario indicare nei requisiti le motivazioni esatte. Ad esempio, è possibile che venga visualizzato un elenco e che l'utente si limiti ad attivare delle caselle di controllo. Allo stesso modo, si potrebbero implementare campi di testo libero per una descrizione più dettagliata. Inoltre, occorre specificare se le voci sono facoltative o obbligatorie.
Il 5° punto è molto vago nella descrizione attuale. Non è chiaro cosa debba significare esattamente il termine disponibilità in questo contesto. Ad esempio, i requisiti dovrebbero prevedere che la pista di controllo possa almeno essere visualizzata su richiesta in qualsiasi momento. Un requisito successivo potrebbe essere la stampa di una pista di controllo corrente.
Nella conversione in formati generalmente leggibili (punto 6), occorre definire in ogni caso quali formati devono essere disponibili almeno come variante di esportazione (ad es. PDF). Questo porta a ulteriori requisiti, come ad esempio che il formato di esportazione non deve consentire alcuna modifica (successiva) del contenuto o che non deve essere utilizzato alcun software proprietario per leggere il formato esportato.
Infine, l'ultimo punto dell'elenco specifica che l'audit trail deve essere controllato regolarmente. L'intervallo di audit e ciò che deve essere verificato esattamente devono essere ancorati in una SOP corrispondente. Questo potrebbe essere rivisto nel contesto di un OQ o di un PQ. Se la SOP non esiste ancora, verrà creata.
Conclusione.
Come dimostrato, la verifica del materiale ridotto rispetto alla dichiarazione iniziale può certamente comportare un certo sforzo. Il vantaggio, tuttavia, sta nei requisiti concreti che ne derivano.
Il metodo dell'analisi qualitativa dei contenuti deve essere applicato a tutte le disposizioni normative e alle linee guida classificate come rilevanti. Per non perdere il livello di dettaglio descritto che può emergere nella fase 4, si raccomanda di includerlo immediatamente nella bozza dei requisiti utente.
Con un'attenta analisi e a seconda del sistema, si possono rapidamente ottenere fino a 20 requisiti per il solo audit trail.
Fonti.
- Medicines & Healthcare products Regulatory Agency (MHRA), "GxP" Data Integrity Guidance and Definitions, marzo 2018.
- EudraLex, Le norme che disciplinano i medicinali nell'Unione Europea, Volume 4, Buone Pratiche di Fabbricazione, Medicinali per Uso Umano e Veterinario, Allegato 11: Sistemi Informatici
- U.S. Department of Health and Human Services, Food and Drug Administration (e CDER, CBER, CDRH, CFSAN, CVM, ORA), Guidance for Industry, Part 11, Electronic Records; Electronic Signatures - Scope and Application Agosto 2003, CGMP farmaceutiche
- ISPE, GAMP, REGISTRI E INTEGRITA' DEI DATI, GUIDA ALLE BUONE PRATICHE: Integrità dei dati per progettazione, 2020
- ISPE, GAMP, GAMP 5, Un approccio basato sul rischio per sistemi computerizzati GxP conformi, 2008
- PIC/s CONVENZIONE SULL'ISPEZIONE FARMACEUTICA SCHEMA DI COOPERAZIONE PER LE ISPEZIONI FARMACEUTICHE GUIDA PIC/S BUONE PRATICHE PER LA GESTIONE E L'INTEGRITÀ DEI DATI IN AMBIENTI REGOLAMENTATI GMP/GDP 1° luglio 2021
- Mayring, P., (2010): Analisi qualitativa dei contenuti: fondamenti e tecniche, 11a ed., Weinheim e Basilea 2010.
- Allegato 2 alla comunicazione del Ministero federale della Salute relativa all'articolo 2 n. 3 dell'ordinanza sulla produzione di medicinali e sostanze attive dell'8 agosto 2011 (BAnz n. 125, pagg. 2901-2906).
